Das Reizdarmsyndrom mit Durchfall (IBS-D) ist ein häufiger chronischer Zustand, der die Lebensqualität erheblich beeinträchtigen kann. Es ist eine der häufigsten Ursachen für gastroenterologische Konsultationen. Die Prävalenz des Reizdarmsyndroms in Tschechien ist vergleichbar mit der in anderen europäischen Ländern. Es wird geschätzt, dass dieses Syndrom in Tschechien bei Frauen etwa 15 % und bei Männern etwas niedriger, bei etwa 10 %, auftritt. Ende 2018 wurde in Großbritannien eine große Studie gestartet, deren Ziel es ist, die Wirksamkeit und Sicherheit des Medizinprodukts ENTEROSGEL® – eines intestinalen Adsorbens, das zur symptomatischen Behandlung des Reizdarmsyndroms zugelassen ist – zu bestätigen. Sponsor der Studie ist der tschechische Hersteller des Produkts, Bioline products s.r.o.
Die Therapie des IBS ist komplex, und es gibt keinen universellen Ansatz. Die Entwicklung neuer Medikamente und Mittel für IBS-D verläuft langsam, und es besteht ein Bedarf an neuen Methoden, einschließlich nichtmedikamentöser Behandlungsoptionen, die einfach anzuwenden sind und für verschiedene Patientengruppen geeignet sind. Zu den derzeit verfügbaren nichtmedikamentösen Therapien gehört das Medizinprodukt ENTEROSGEL®. Dieses intestinale Adsorbens ist zur symptomatischen Behandlung des Reizdarmsyndroms mit Durchfall sowie bei akuten Durchfällen zugelassen. ENTEROSGEL® ist in Tschechien und in über 30 weiteren Ländern weltweit rezeptfrei erhältlich.
Der Grund für den Einsatz des intestinalen Adsorbens ENTEROSGEL® zur Behandlung der Symptome des IBS liegt in seiner Fähigkeit, verschiedene Toxine und andere schädliche Substanzen zu binden und zusammen mit dem Stuhl aus dem Gastrointestinaltrakt zu entfernen [1]. Es gibt zudem Hinweise darauf, dass die Anwendung des intestinalen Adsorbens Dioctahedral Smectit die Funktion der Darmbarriere stärken kann, die das Eindringen proinflammatorischer Zytokine in den Darm verhindert [2,3]. Obwohl die Rolle der Darmbarriere beim IBS noch nicht vollständig erforscht ist, gibt es zunehmend Hinweise darauf, dass ihre Funktion beim IBS unabhängig vom Subtyp der Erkrankung verändert ist [4].
Obwohl umfangreiche Forschungen zu ENTEROSGEL® durchgeführt wurden, einschließlich Pilotstudien bei IBS-D, die eine Normalisierung der Stuhlfrequenz und -konsistenz sowie eine Schmerzreduktion berichteten [5, 6], enthielt bisher keine Studie eine Placebo-Kontrollgruppe. Die Schwierigkeit bei der Verwendung eines Placebos für ENTEROSGEL® besteht darin, dass Substanzen mit einer gelartigen Konsistenz, wie z. B. auf Gelatine- oder Stärkebasis, selbst Wirkungen im Gastrointestinaltrakt haben könnten und daher als Placebo ungeeignet sind.
Vor diesem Hintergrund wurde Ende 2018 in Großbritannien eine randomisierte, doppelblinde, multizentrische Studie gestartet, die diese Herausforderungen überwinden soll. An der Studie sind 27 Krankenhäuser und medizinische Zentren in ganz Großbritannien beteiligt. Ziel dieser Untersuchung ist es, die Wirksamkeit und Sicherheit von ENTEROSGEL® im Vergleich zu Placebo bei der symptomatischen Behandlung von 430 Patienten mit IBS-D nach den ROME-IV-Kriterien zu bestätigen. Sponsor der Studie ist der tschechische Hersteller des Produkts, Bioline products s.r.o.
In der Studie werden die Patienten in zwei Gruppen aufgeteilt: Die eine Hälfte erhält ENTEROSGEL®, die andere Hälfte ein Placebo (die Patienten wissen nicht, welches Präparat sie einnehmen) für einen Zeitraum von 8 Wochen. Da viele Patienten mit ihrer bisherigen Therapie keine ausreichende Symptomlinderung erfahren, erhalten anschließend alle Patienten ENTEROSGEL® für weitere 8 Wochen, sodass auch diejenigen, die zuvor das Placebo erhalten haben, die Therapie mit ENTEROSGEL® ausprobieren können. In beiden Phasen können die Patienten die Dosierung von ENTEROSGEL® entsprechend der Schwere ihrer Symptome anpassen (von 1 Esslöffel täglich bis zu 6 Esslöffeln täglich; bisher beträgt die Standarddosis bei IBS-D dreimal täglich 1 Esslöffel).
Während der Studie füllen alle Patienten täglich einen Fragebogen aus, in dem sie zu ihren IBS-Symptomen, ihrer Lebensqualität, Arbeitsproduktivität, täglichen Aktivitäten und ihrem allgemeinen Gesundheitszustand befragt werden. Dieser Fragebogen wird auch in der offenen Phase der Studie fortgeführt, in der die Patienten bereits wissen, dass sie ENTEROSGEL® einnehmen.
Nach Abschluss der Studie durch den letzten Patienten werden die primären und sekundären Endpunkte ausgewertet.
Der primäre Endpunkt der Studie wird als prozentualer Anteil der Therapieansprecher anhand der Daten aus dem Fragebogen gemessen. Damit ein Patient als Therapieansprecher gilt, muss er eine Reduktion der Stuhlfrequenz um mindestens 50 % und gleichzeitig eine Reduktion der Bauchschmerzen um mindestens 30 % pro Woche über einen Zeitraum von mindestens 4 Wochen der insgesamt 8-wöchigen Studienphase aufweisen.
Zu den sekundären Endpunkten gehören die Bewertung der Stuhlfrequenz, Stuhlkonsistenz, Bauchschmerzen, Blähungen, Stuhldrang, allgemeine Linderung der IBS-Symptome, Schwere der IBS-Symptome, Arbeitsproduktivität und tägliche Aktivität, Lebensqualität, weitere somatische Symptome (zB. Kopfschmerzen, Müdigkeit) sowie die Häufigkeit unerwünschter Arzneimittelwirkungen.
Der Abschluss der Studie ist für Ende 2020 geplant, und nach der Auswertung der Daten wird die Studie so schnell wie möglich veröffentlicht.
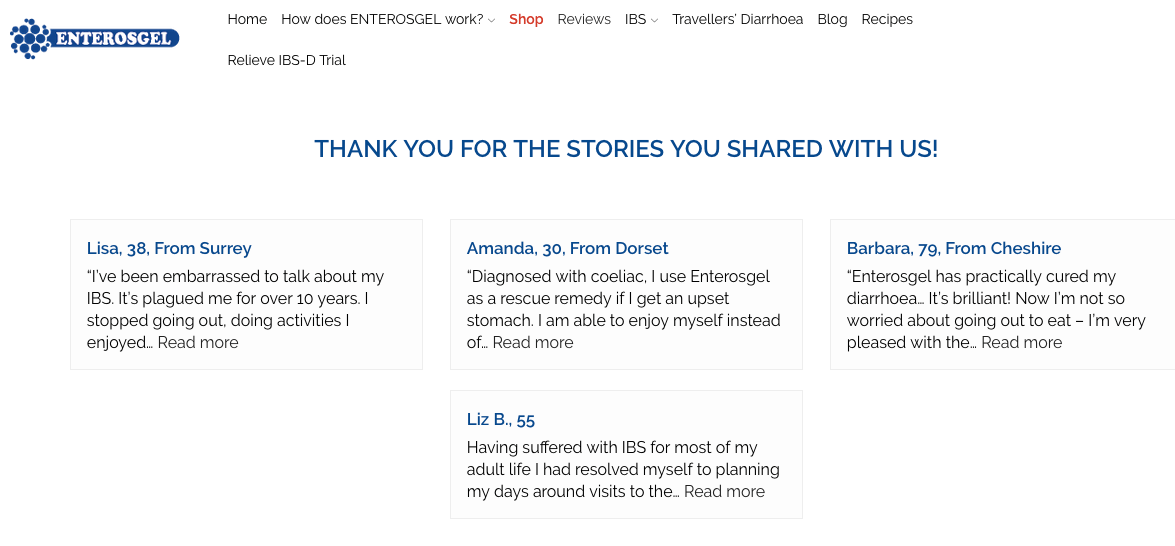
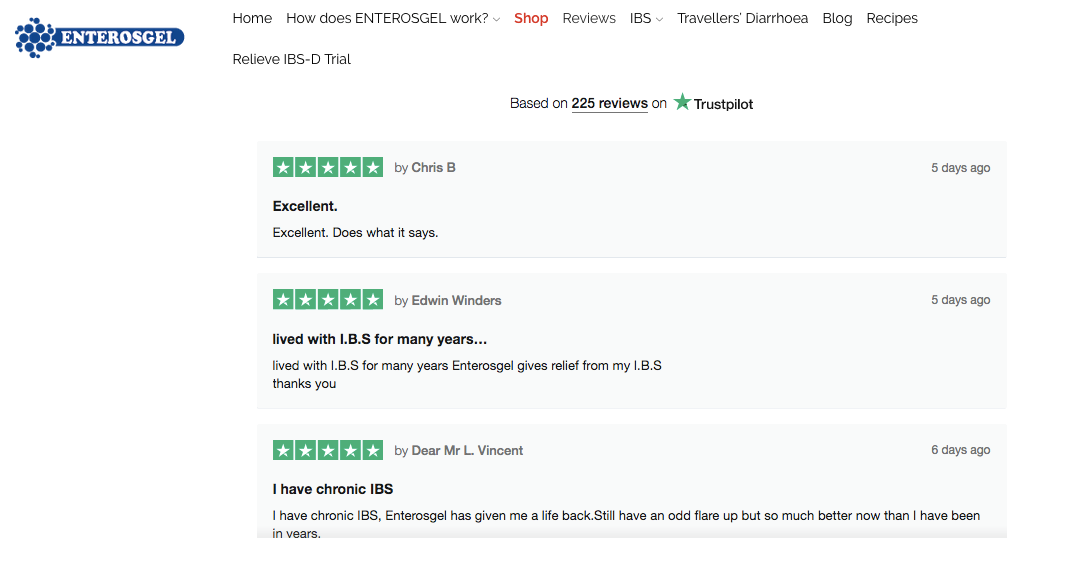
Bereits während der Studie begannen jedoch auf der britischen Produktwebsite (https://enteromed.co.uk/reviews/) positive Bewertungen, Kommentare und Dankesnachrichten von Patienten zu erscheinen, denen ENTEROSGEL® bereits geholfen hat, ihre Lebensqualität zu verbessern.
QUELLEN:
1. Howell CA, Mikhalovsky SV, Markaryan EN, Khovanov AV. Investigation of the adsorption capacity of the enterosorbent ENTEROSGEL® for a range of bacterial toxins, bile acids and pharmaceutical drugs. Sci Rep. 2019;9(1):5629.
2. Leonard AJD-LM, Allen A. Pepsin damage in rat stomach in vivo: effect of smectite and dimethyl prostaglandin E2. Gastroenterology. 1993;104:A132.
3. Mahraoui L, Heyman M, Plique O, Droy-Lefaix MT, Desjeux JF. Apical effect of diosmectite on damage to the intestinal barrier induced by basal tumour necrosis factor-alpha. Gut. 1997;40(3):339–43.
4 González-Castro AM, Martínez C, Salvo-Romero E, Fortea M, Pardo-Camacho C, Pérez-Berezo T, Alonso-Cotoner C, Santos J, Vicario M. 2017. Mucosal pathobiology and molecular signature of epithelial barrier dysfunction in the small intestine in irritable bowel syndrome. 32:53-63.
5. Tkachenko EIAE, Skazyvaeva EV, Ivanov SV, Pushklna AV, Lapinskii IV. Efficiency and safety of ENTEROSGEL® (polymethylsiloxane polyhydrate) in the treatment of irritable bowel syndrome. Minerva Gastroenterol Dietol. 2015;61(N2):1–5.
6. Pavlov AIFZV. Tactics of management of diarrhoea of non-infectious genesis in hospital (in Russian). Military Med J. 2018;6:49–54.
http://www.isrctn.com/ISRCTN17149988
Kemppinen, A., Howell, C., Allgar, V. et al. Randomised, double-blind, placebo controlled multi-centre study to assess the efficacy, tolerability and safety of ENTEROSGEL® in the treatment of irritable bowel syndrome with diarrhoea (IBS-D) in adults. Trials 21, 122 (2020).
Hlavatá K., Syndrom dráždivého tračníku Irritable Bowel syndrome, Geriartie a Gerontologie 2018,7,č.2:86